مطالب علمی (66)
زیر مجموعه ها
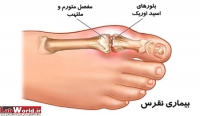
نقرس یک اختلال متابولیسم بازهای آلی پورین میباشد و با آرتریت حاد و هیپراوریسمی شناخته میشود. بیماری نقرس را بیماری پولدارها مینامند چرا که این بیماری در اثر مصرف میزان بالای پروتئین پدید میآید و از آنجائی که مواد غذایی حاوی پروتئینهایی با کیفیت مانند گوشت، مرغ، ماهی و تخم مرغ جزو غذاهای گران قیمت بشمار میآیند این بیماری را بیماری پولدارها نام نهادهاند.
بیماری نقرس به نوعی ثابت میکند بر خلاف آنچه برخی میکوشند به ما بقبولانند مبنی بر اینکه باید روزانه به مقدار زیادی پروتئین مصرف کنیم تا تندرستیمان تضمین گردد، مصرف مجاز پروتئین برای یک فرد ۷۰ کیلوگرمی برابر با ۵۶-۴۲ گرم است که با مصرف روزانه ۳ برش نان بربری (هر برش به اندازه یک کف دست) و به اندازه یک قوطی کبریت پنیر و به اندازه دو بند انگشت گوشت و یا حتی همان نانی که برای صبحانه میخورید و ۱۰۰ گرم آجیل تأمین میگردد.
بیماران مبتلا به نقرس عموماً دچار حملههای شدید همراه با درد میشوند که اصولا در مناطق حساس دست و پا و اکثرا مفصلها پدید میآید، حملههای نقرسی بسیار شدید و دردناک است! معمولا درد در ناحیه شصت پا شروع میشود و به نحوی دردناک است که از خواب بیدارتان میکند. البته درمان این بیماری سادهاست و با تجویز داروهایی مانند کلشی سین به سرعت درد مرتفع میشود. نقرس بیماری است که خود را با افزایش اسیداوریک خون، التهاب دردناک مفاصل، رسوب کریستالهای اورات سدیم و سنگهای کلیوی اسیداوریکی نشان میدهد.
طبق آمار موجود، از هر ۱۰۰۰ مرد حدود ۷ نفر و از هر ۱۰۰۰ زن حدود ۱ نفر به این بیماری مبتلا میشوند. میزان بروز این بیماری در مردان، با میزان اسیداوریک خون ارتباط دارد، به طوری که با اسید اوریک کمتر از ۷ میلیگرم در دسیلیتر، میزان این بیماری به ۱/۰ و با اسید اوریک بالای ۹ میلیگرم در دسیلیتر، میزان بروز این بیماری به ۵ درصد میرسد. مقدار طبیعی اسید اوریک در خانمها بین ۶ - ۶/۲ و در آقایان ۲/۷ - ۵/۳ میلیگرم در دسیلیتر است.
نقرس در اثر تولید بیش از حد یا دفع کمترازحد اسید اوریک (یا هر دو) بوجود میآید. از میزان۶۰۰ تا ۷۰۰ میلیگرم اسید اوریکی که روزانه دفع میشود، یک سوم از رژیم غذایی (پورین موجود در مواد غذایی مصرفی) و دو سوم از منابع داخلی بدن حاصل میشود.
۱۰ درصد موارد نقرس بر اثر تولید بیش از حد اسیداوریک و ۹۰ درصد آن بر اثر کاهش دفع اسیداوریک است. برخی از داروها و اختلالات و بیماریها هم میتوانند عامل افزایش غلظت اسید اوریک باشند. داروهایی که میتوانند در این زمینه نقش داشته باشند عبارتند از: مصرف طولانی مدت و زیاد داروهای مُدر، لوودوپا، اسید نیکوتینیک، پیرازینامید و … . مصرف الکل و مشروبات الکلی نیز از عوامل افزایش اسید اوریک خون میباشد.
از اختلالاتی که میتواند منجر به افزایش اسیداوریک خون شود، میتوان به لوسمیها (سرطان خون)، لنفوم، نارسایی کلیه، گرسنگیهای طولانی و مفرط، چاقی، مسمومیت با سرب و … اشاره کرد.
شایعترین علامت بیماری نقرس در کنار افزایش سطح اسیداوریک خون، التهاب مفصلی دردناک است. همان طور که گفته شده، معمولا به صورت درد در مفاصل اندام تحتانی و در درجه اول انگشت شست پاست که البته سایر نقاط بدن به ترتیب شیوع، بعد از مفصل انگشت شست پا، میتواند مچ پا، پاشنهها، زانوها، مچ انگشتان دستها و آرنج باشد.
رژیم محدود از پورین به عنوان یک کمک فرعی برای درمان دارویی جهت کاهش ترشح اسید اوریک تا میزان ۲۰۰ تا ۴۰۰ میلی گرم در روز میتواند کمک کننده باشد (همان طور که گفته شد حدود ۷۰۰- ۶۰۰ میلیگرم اسید اوریک از یک فرد عادی روزانه دفع میشود) و میزان سطح اوریک را تا ۱ میلیگرم در دسیلیتر پایین میآورد.
در رژیم محدود از پورین، دریافت پورین روزانه به حدود ۱۵۰-۱۲۰ میلیگرم در مقایسه با دریافت معمولی آن که ۱۰۰۰-۶۰۰ میلیگرم در روز است، کاهش مییابد. این رژیم به عنوان یک عامل کمکی در بیماری نقرس و سایر ناهنجاریهای موثر بر متابولیسم پورین تجویز میشود و برای پایین آوردن سطح اوریک در بدن طراحی شدهاست.
در این رژیم، منابع غذایی سرشار از پورین نظیر جگر، مغز، دل و قلوه و کله پاچه گوسفند، مخمر(ماءالشعیر)، عصاره گوشت، اندامهای غدهای، ماهی و غذاهای دریایی، گوشت، لوبیا، نخود، زردچوبه، قارچ، گل کلم و اسفناج با توجه به شرایط بیمار محدود میشود. مصرف این غذاها در طی حمله حاد نقرس، مجاز نمیباشد و هنگامیکه مرحله حاد فروکش میکند، فرد مجاز به مصرف یک سهم غذایی ۶۰ گرمی از این غذاها خواهد بود.
بیماران میتوانند غذاهایی را که اساسا عاری از پورین است به دلخواه مصرف نمایند. این غذاها عبارتند از: نان و غلات، شیر و فرآوردههای لبنی، تخممرغ، میوهها، سبزیها و نوشیدنیهای غیر الکلی.
مصرف روزانهٔ پروتئین ۳۲۸۱ به حدود ۸/۰ گرم به ازای هر کیلوگرم وزن بدن محدود میشود. میزان مصرف پروتئین یک فرد عادی حدود ۱ گرم به ازای هر کیلوگرم وزن بدن است. مثلا یک فرد ۷۰ کیلوگرمی به ۷۰ گرم پروتئین نیاز دارد. مصرف روزانه گوشت نباید از ۱۲۰-۹۰ گرم بیشتر باشد.
برای افزایش دفع اسید اوریک لازم است، بیماران رژیم غذایی سرشار از کربوهیدرات (مثل نان، برنج، ماکارونی، غلات و …) و کمچربی داشته باشند و خصوصا در وعدهٔ شام از خوردن غذاهای سنگین و زیاد پرهیز کنند.
کنترل و حفظ وزن مطلوب برای این بیماران از اهمیت خاصی برخوردار است. بنابراین باید سعی کنند با رعایت رژیم غذایی متعادل و انجام حرکات ورزشی و خصوصا پیادهروی وزن خود را در حد ایدهآل حفظ کنند.
برای رقیق کردن ادرار و تسریع در دفع اسید اوریک و پیشگیری از رسوب اسید اوریک در کلیهها و تشکیل سنگهای کلیوی، نوشیدن آب و مایعات به مقدار فراوان برای این بیماران توصیه میشود، طوری که روزانه نوشیدن حدود ۳ لیتر مایعات برای این بیماران ضروری است. بیماران باید از نوشیدن نوشیدنیهای حاوی الکل اجتناب کنند، زیرا الکل دفع اسید اوریک توسط کلیهها را مهار میکند.
ادامه مطلب...در ایام گذشته آزمایش های تشخیص پزشکی توسط پزشکان انجام می شد ( ابوعلی سینا)
در سال 1916 دکتر Todd در دانشگاه کلرادو بخش آسیب شناسی بالینی را ایجاد کرد.
دستگاه رنگ سنج Klett Biocolorimeter در دهه 1930 ابداع شد.
در دهه 1940 فوتومتر و اسپکتروفتومتر ابداع شد (روش های دستی)
در دهه 1950 برای اولین بار توسط شرکت Technicon آمریکا دستگاه اتو آنالایزر به بازار عرضه شد.
روش های جذب سنجی
روش های جذب سنجی یکی از قدرتمندترین و رایج ترین روش های اندازه گیری طیف وسیعی از آنالیت ها محسوب می شوند. بسیاری از دستگاه های مورد استفاده در آزمایشگاههای تشخیصی بر پایه اندازه گیری میزان جذب یا عبور انرژی تشعشعی ساخته شده اند.
اسپکتروفتومتر یا فتومتر ابزاری است که برای اندازه گیری انرژی جذبی یا عبوری نور مورد استفاده قرار می گیرد.
تشعشع الکترومغناطیسی (EMR) جریانی از انرژی است که با سرعت نور در جهان انتشار می یابد. و به صورت امواج ماکسول و جریانی از ذرات تحت عنوان فوتون وجود دارد.
طیف فرکانس های EMR از مقادیر بسیار پایین در مورد امواج رادیویی تا مقادیر بالاتر از جمله امواج فرابنفش، اشعه ایکس و اشعه گاما متفاوت است.
جنس و خواص نور:
نور در واقع نوعی انرژی با خاصیت دو گانه موج و ذره است.
یک موج الکترومغناطیسی از دو جزء الکتریکی و مغناطیسی با مولفه های عمود بر هم در راستای جهت انتشار تشکیل شده است.
نوری که معمولا در درجه حرارت های بالاتر از مواد ساطع می شود علاوه بر خاصیت الکتریکی دارای خاصیت مغناطیسی نیز می باشد.
قوانین بیر- لامبرت (Beer - Lamberts):
هرگاه یک نور ساده تکفام با شدت I0عمود بر سطح تابش وارد یک محلول شفاف و یکنواخت به ضخامت L و غلظت C گردد بخشی از آن جذب شده قسمتی منعکس و قسمت دیگر از محلول عبور می کند بنابراین:
Ir+Ia+lt= I0
Ir: بخش انعکاس یافته است که میزان ناچیزی را به خود اختصاص می دهد.
Ia: بخش جذب شده که به غلظت آنالیت بستگی دارد.
It: بخش عبور کرده از محلول می باشد.
طبق نظر لامبرت هرگاه یک دسته شعاع نور تکفام (I) از محلولی به ضخامت L عبور کند کم شدن شدت نور متناسب با ضخامت محلول خواهد بود dI~L
طبق نظر بیر هرگاه یک دسته شعاع تکفام از محلولی به غلظت C عبور کند کم شدن شدت نور متناسب با غلظت آنالیت در محلول می باشد.
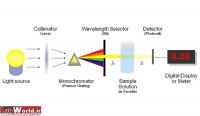
دستگاههایی که برای جذب سنجی به کار می روند عبارتند از: فتومترها و اسپکتروفتومترها. در فتومترها از فیلتر به عنوان تکفام ساز(Monochoromator) استفاده می شود لذا بخش محدودی از طول موج قابل دسترسی می باشد اما در اسپکتروفتومترها منشور و سیستمهای (Grating) به عنوان تکفام ساز عمل می کنند.
فتومترها و اسپکتروفتومترها:
اسپكتروفتومترها، تجهيزاتي است كه جذب يا عبور طول موجهاي مشخصي از انرژي تابشي (نور) از يك آناليت را در يك محلول تعيين ميكنند. به دليل تفاوت در تعداد و آرايش گروهها، پيوندهاي دوگانه اتمهاي كربن در هر مولكول نور را در طول موجهاي خاص با الگوي طيف مشخص، جذب ميكند. بر اساس قانون بير- لامبرت، مقدار نوري كه در اين طول موج مشخص جذب ميشود مستقيما با غلظت آن نمونه شيميايي متناسب است. اسپكتروفتومترهاي مرئي و فرابنفش، رايجترين دستگاههاي جذب سنجي در مراكز تشخيصي و آزمايشگاهي است.
اسپكتروفتومتر نور مرئي
در آزمايشگاهها، بخش گسترده اي از اندازه گيريها بر اساس واكنشهاي جذب سنجي صورت ميپذيرد. فعاليت اكثر آنزيمها، تري گليسيريد، كلسترول، ليپو پروتئينها، قند، كراتينين، اوره و... طيف وسيعي از آناليتها با كاربردهاي باليني و تحقيقاتي، طيف وسيعي از داروها و بخش گستردهاي از متابوليتها با اسپكتروفتومتري قابل سنجش است. بررسي ساختمان مولكولي، شناسائي تركيبات، مقايسه ساختمانها، يافتن طول موج ماكزيمم جذب و... از ديگر كاربردهاي اسپكتروفتومتري در مسائل تحقيقاتي است.
اجزا دستگاه:
شش قسمت اصلی در ساختمان اسپکتروفتومترها وجود دارد که عبارتند از:
1) منبع نور
2) مونوکروماتور
3) متمرکز کننده پرتو
4) محل نمونه
5) آشکارساز
6) دستگاه نمایش خروجی
1) منبع نور:
منبع نور در اثر افزایش حرارت به کمک الکتریسیته در یک لامپ تامین می شود شرایط اصلی این منبع شدت کافی، پایداری و پیوستگی اجزاء آن است. برای تامین نور مرئی از لامپ های تنگستن (با طول موج توليدي بين nm 900-330) استفاده می شود. برای تولید پرتوهای فرابنفش از لامپهای هیدروژنی یا دوتریومی (با طول موج nm 450 -200) بهره گرفته می شود.
2) تکفام ساز ((Monochromator:
این قسمت دستگاه پرتو چند فام را به پرتو تکفام تبدیل می کند این عمل ممکن است توسط منشور یا سیستم گریتینگ انجام شود. فیلترها شیشه های رنگی هستند که بخش اعظم پرتوها را جذب کرده و فقط طول موج های محدودی را عبور می دهند. فیلترها باید پرتویی را که آنالیت جذب می کند از خود عبور دهند. منشورها و سیستم گریتینگ بر اساس اختلاف ضریب شکست می توانند طول موجهایی حتی با پهنای 1/0 نانومتر تولید کنند. سیستم گریتینگ در اصل یک صفحه صیقلی است که تعداد زیادی خطوط نازک و موازی بر روی آن حک شده و کار منشور را به نحو بهتری انجام می دهد.
3) متمرکز کننده پرتو (Focusing device):
با ترکیبی از عدسی ها شکاف بین دو تیغه باریک فلزی و آیینه ها در مسیر پرتو تابش پرتوها مواز ی می شوند و با تنظیم عرض شکاف می توان عرض پرتو را تنظیم کرد. هر قدر عرض شکاف نور بکار رفته کمتر باشد کیفیت پرتوها بهتر خواهد بود.
4) محل نمونه:
کووتها (Cuvet) قسمتی از دستگاه هستند که نمونه مورد نظر یا بلانک در آن قرار می گیرد این بخش معمولا به صورت استوانه ای یا مستطیلی بوده از شیشه کوارتز یا پلاستیک ساخته شده است.
کووتهای پلاستیکی و شیشه ای برای محدوده مرئی بکار می روند. به دلیل جذب پرتوهای با طول موج کمتر از 350 نانومتر توسط کووتهای شیشه ای برای محدوده فرابنفش از کووتهای گران قیمت کوارتزی یا سیلیسی استفاده می شود.
5) آشکارسازها (Detectors):
آشکارسازها دستگاههایی هستند که یک نوع از انرژی را به نوع دیگری تبدیل می کنند و معمولا به سه گروه اصلی تقسیم می شوند: 1- فتوالکتریکی 2- فتوشیمیایی 3- حرارتی. در دستگاههای اسپکتروفتومتر از آشکارسازهای فتوالکتریکی استفاده می شود. فتوسل و فتوتیوب از ساده ترین آشکارسازها می باشند.
فتوترانزیستورها و فتودیودها نیز برای این منظور استفاده می شوند. برای اندازه گیری نورهای ضعیف از (Photomultiplier Tubes) PMT بهره گرفته می شود. PMTها سریعتر جواب می دهند وعلاوه بر حساسیت بالا با دوام تر از سایر آشکارسازها می باشند.
6) دستگاه نمایش خروجی
این قسمت می تواند یک گالوانومتر صفحه ثبات اسیلوسکوپ یا صفحه نمایشگر کامپیوتر با نرم افزارهای متنوع باشد.
اسپكتروفتومتر فرابنفش ((Ultraviolet
ساختماني همانند اسپكتروفتومتر نور مرئي داشته و به طول موجهاي نور فرابنفش حساس است.
اسپكتروفتومتر نشر شعله ((Flame
ساختمان اين دستگاه شبيه اسپكتروفتومتر يا فتومتر ساده است با اين تفاوت كه در فتومتر، لامپ الكتريكي و در اين دستگاه نور حاصل از سوختن ماده مورد آزمايش در درون شعله به عنوان منبع نوري در نظر گرفته ميشود. در طيف سنجي نشر شعله، نور حاصل مستقيما اندازهگيري ميشود.
اسپكتروفتومتر جذب اتمي (Atomic Absorption)
اسپكتروفتومترهاي جذب اتمي (AAS) غلظت عناصر فلزي كه از نظر پزشكي براي حفظ سلامتي مهم است را اندازه گيري ميكند. در خصوص اين عناصر ميتوان به كلسيم، منيزيم، مس، روي و آهن اشاره نمود. اسپكتروفتومترهاي جذب اتمي همچنين براي تعيين اينكه آيا سطح درماني داروهايي نظير ليتيم در خون، تامين شده است يا خير و همچنين براي آشكارسازي و تعيين كميت سموم فلزي مورد استفاده قرار ميگيرد.
تعیین طول موج ماکزیمم (maxλ)
محلول 10 میلی گرم در لیتر برومو فنول بلو را تهیه کنید. ابتدا صفر عبور را در حالی که دستگاه خالی است تنظیم کنید. در مرحله بعد به وسیله بلانک ( محلولی که تمام مواد موجود در محلول آزمایش را دارد به جز ماده مورد آزمایش) در دستگاه قرار دهید و دستگاه را روی عدد صد در صد عبور تنظیم نمائید. در این قسمت محلول مورد آزمایش را در طول موج های متفاوت بررسی نمائید و مقدار جذب نور را در آن طول موج ها به دست آورید. در نهایت منحنی مربوط به طول موج های خوانده شده را رسم کنید و حداکثر جذب خوانده شده مربوط به طول موج ها را مشخص نمائید. توجه داشته باشید که برای هر طول موج می بایست دستگاه را با بلانک صفر نمائید.
تایید قانون بیر- لامبرت
در این آزمایش منحنی دانسیته نوری را بر حسب غلظت های مختلف به دست خواهید آورد و قانون بیر- لامبرت را تائید خواهید نمود. با انتخاب 6 لوله آزمایش طبق جدول زیر عمل نمائید.
|
6 |
5 |
4 |
3 |
2 |
1 |
شماره لوله ها محلول ها |
|
5 |
4 |
3 |
2 |
1 |
- |
برمو فنول بلو(ml) |
|
- |
1 |
2 |
3 |
4 |
5 |
آب مقطر(ml) |
صفر دستگاه را با استفاده از لوله شماره 1 تنظیم نمائید و مقدار دانسیته نوری مربوط به لوله های بعدی را در طول موج ماکزیمم به دست آمده از مرحله قبل را بخوانید. سپس منحنی جذب نوری را در غلظتهای مختلف به دست آورده و مشخص نمائید که آیا قانون بیر- لامبرت تائید می شود یا نه؟
ادامه مطلب...ميكروبهاي گرفتار شده در بلورهاي يخ ميتوانند براي بيش از 100 هزار سال زير 3 كيلومتر برف زنده بمانند. اين يافته از اين نظريه پشتيباني ميكند كه شايد زندگي در دور دستها در جهانهاي يخي سامانهي خورشيدي ما وجود داشته باشد. باكتريهاي زنده در نمونههاي برداشت شده از ژرفاي 4 كيلومتري جنوبگان پيدا شدهاند، گرچه برخي دانشمندان گفتهاند كه آن ميكروبها در پي آلودگي نوك متهها يا در آزمايشگاه به بلورهاي يخ راه يافتهاند. اما در سال 2005 نيز باكتريهايي با ديرينگي 32 هزار سال به صورت خفته در آبگير يخ زدهاي در آلاسكا يافت شدند. اكنون بافورد پرايس و رابرت رُده، فيزيكدانهاي دانشگاه كاليفرنيا در بركلي ايالات متحده آمريكا، سازوكاري پيشنهاد كردهاند كه توضيح ميدهد چگونه ميكروبها ميتوانند در چنين شرايط سختي زنده بمانند. آنان ميگويند لايه نازكي از آب مايع خودبهخود پيرامون ميكروب را فرا ميگيرد. سپس، گازهاي اكسيژن، هيدرژن، متان و گازهاي ديگر از حبابهاي هوا به درون آن انتشار مييابند و غذاي كافي را براي ميكروب فراهم ميسازند.
بنابراين، هر ميكروبي ميتواند در يخ جامد زنده بماند و دماي پايينتر از 55- درجه سلسيوس و فشار 300 اتمسفر را تحمل كند. در چنين شرايطي ميكروبها نميتوانند توليد مثل كنند، اما ميتوانند هر آسيب مولكولي را ترميم كنند و تا هزاران سده زنده بمانند.
ادامه مطلب...
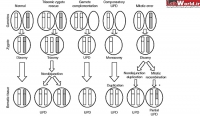
(Uniparental Disomy (UPD: در صورتی که هر دو کروموزوم همولوگ در یک سلول تخم از یک والد باشند، ناهنجاریهایی ایجاد میشود. این ناهنجاریها Uniparental Diploidy و Uniparental Disomy نام دارند. این ناهنجاریها بعلت تفاوت imprinting در کروموزومهای مادری و پدری رخ می دهد.
در حالت Uniparental Diploidy، هر دو سری هاپلوئید از یک والد می باشند. یعنی همه 46 کروموزوم از یک والد منشا گرفته. در این حالت کلیه لوکوسهای ژنوم سلول تخم هموزیگوت می باشند و ژنوم دیپلوئید تخم، از مضاعف شدن ژنوم هاپلوئید اسپرم یا اوول حاصل شده است. در صورتی که ژنوم سلول تخم از مضاعف شدن ژنوم هاپلوئید اسپرم حاصل شود، بیماری hidatidiform mole ایجاد می شود. در این بیماری در رحم مادر بافت تروفوبلاست رشد زیادی می یابد اما بافتهای جنینی رشد چندانی ندارند، در این حالت امکان تبدیل
در صورتی که هر دو کروموزوم همولوگ در یک سلول تخم از یک والد باشند، ناهنجاریهایی ایجاد میشود. این ناهنجاریها Uniparental Diploidy و Uniparental Disomy نام دارند. این ناهنجاریها بعلت تفاوت imprinting در کروموزومهای مادری و پدری رخ می دهد.
در حالت Uniparental Diploidy، هر دو سری هاپلوئید از یک والد می باشند. یعنی همه 46 کروموزوم از یک والد منشا گرفته. در این حالت کلیه لوکوسهای ژنوم سلول تخم هموزیگوت می باشند و ژنوم دیپلوئید تخم، از مضاعف شدن ژنوم هاپلوئید اسپرم یا اوول حاصل شده است. در صورتی که ژنوم سلول تخم از مضاعف شدن ژنوم هاپلوئید اسپرم حاصل شود، بیماری hidatidiform mole ایجاد می شود. در این بیماری در رحم مادر بافت تروفوبلاست رشد زیادی می یابد اما بافتهای جنینی رشد چندانی ندارند، در این حالت امکان تبدیل توده تروفوبلاستی به توده توموری کوریوکارسینوما (choriocarcinoma) وجود دارد.
در صورتی که ژنوم سلول تخم از مضاعف شدن ژنوم هاپلوئید اوول حاصل شود، بیماری ovarian teratoma که یک نوع سرطان تخمدان است ایجاد می شود. در این بیماری در تخمدان، بافتهای جنینی ایجاد می شود. در Uniparental Disomy یا (UPD) یکی از کروموزومها به صورت همولوگ از یک والد به ارث می رسد. در صورتی که هر دو کروموزوم همانند باشند به آن isodisomy گویند. در حالت ایزودیزومی کلیه لوکوسهای کروموزوم فوق به صورت هموزیگوت می باشند.
علت ایجاد UPD معمولا Trisomic Rescue می باشد. در این حالت، ابتدا یک سلول تخم تریزومیک پدید می آید. سپس طی چند میتوز دارای Nondisjunction در مراحل اولیه زیگوتی چند سلول دیپلوئید پدید می آیند. در تقسیمات بعدی سلولهای تریزومی به علت عدم تعادل ژنتیکی می میرند و فقط سلول دیپلوئید زنده می ماند و جنین را تشکیل می دهد. در این حالت احتمال ایجاد حالت UPD، 2/3 است.
ادامه مطلب...تست كومبس مستقيم (DAT) در سال ١٩٤٥ آقاي كومبس با همكارانش گروهي از آنمي ها هموليتيك را كه علتش گروهي از آنتي بادي ها بودند تشخيص دادند به همين دليل روند اين آزمايش را ” كومبس” نام گذاري كردند.
كومبس مستقيم، حساس شدن گلبولهاي قرمز را در داخل گردش خون توسط آنتي بادي و يا اجزاءكمپلمان و يا هر دو را نشان مي دهد.
در حالت عادي “برای مثال” rbc با چندين IgG يا اجزا كمپلمان (حدود ٤٠ تا ٥٠) آغشتگي دارد، اما زماني كومبس + است كه اين اتصالات بيشتر باشد (حدود ٥٠٠).
در اثر اين اتصالات، بدن واكنش مي دهد مثلا ماكروفاژ با Fc رسپتور هاي خود به Fc آنتي بادي هاي متصل به rbc مي چسبد و باعث تخليه آن مي شود و اين تست براي تشخيص و جلوگيري از اين واكنش انجام مي شود.
موارد كاربرد
١. تشخيص آنمي اتوايميون يا hemolytic anemia ناشی از تولید اتو انتی بادی علیه گلبول های قرمز خودی است.
٢. بیماری های همولیتیکی نوزادان یا erythroblastosis fetalis که به علت ناسازگاری خونی خصوصا Rh بین مادر و جنین است.
٣. كم خوني همولیتیک متعاقب مصرف برخي از داروها
٤. كم خوني همولیتیک در نتيجه آلو آنتي بادي هاي ناشي از تزريق خون كه اخيراً به بيمار صورت گرفته است .
٥. هموگلوبينوري حمله اي سرد (PCH)
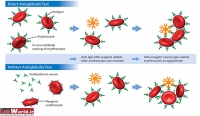
از این تست برای شناسایی آنتیبادیهای ناقص ـ که بر روی RBC نشسته و آنها را حساس کرده است استفاده میشود. این تست به دو روش مستقیم و غیرمستقیم انجام میشود. اساس این تست بر ایجاد شبکه بین آنتیبادیهای ناقص در سطح گلبولهای قرمز حساس شده (توسط AHG) برای ایجاد آگلوتیناسیون میباشد. این تست در دو مرحله کلی انجام میشود:
۱. مرحله حساس شدن
۲. اضافه کردن معرف کومبز
کومبز مستقیم
از کومبز مستقیم برای شناسایی آنتیبادیهای ناقص متصل به RBC جنین استفاده میشود. تفاوتی که بین کومبز مستقیم و غیرمستقیم وجود دارد این است که، مرحله حساس شدن گلبولهای قرمز در بدن جنین اتفاق میافتد. عامل اصلی حساس شدن RBC (در ۷۵% موارد) ناسازگاری گروههای خونی RH میباشد هر چند که گروههای خونی ABO در ۲۵ درصد موارد هم میتوانند باعث حساس شدن RBC شوند.
ناسازگاری RH
اگر خون جنین+Rh و خون مادر -Rh باشد آنتیبادیهای تولید شده از کلاس Igg در بدن مادر از جفت عبور کرده و باعث حساس شدن RBCهای جنین میشود.
ناسازگاری ABO
این ناسازگاری زمانی باعث حساس شدن RBC میشود که گروه خونی مادرO و گروه خونی جنین AB باشد در این صورت آنتیبادی 3 Igg آنتی AB موجود در سرم مادر به جنین منتقل شده و باعث حساس شدن RBC جنین میشود.
روش انجام تست کومبز مستقیم
خون بند ناف را گرفته و از آن سوسپانسیون ۵ درصد گلبولهای قرمز تهیه میکنیم. چون مرحله حساس شدن RBC در بدن جنین اتفاق افتاده است بنابراین نیازی به انکوبه کردن نیست.
۰/۱ میلیلیتر از سوسپانسیون ۵ درصد RBC را به ۱/۰میلی لیتر AHG اضافه میکنیم و برای تشکیل شبکه بین RBC، لولههای تست را به مدت ۳ تا ۵ دقیقه در دمای آزمایشگاه نگه میداریم. بعد از ۵ دقیقه، لولهها را در۱۰۰۰ و به مدت یک دقیقه سانتریفیوژ میکنیم. در آخر هم لولهها را از نظر آگلوتیناسیون با زدن ضربهای ضعیف به لوله، بررسی میکنیم.
بررسی نتایج
اگر آگلوتیناسیون مشاهده شود، نشان دهنده حساس بودن RBC جنین است و باید تعیین تیتر شود (که در این تعیین تیتر، AHG را رقیق می کنیم نه سرم را) چون در زایمان دوم به بعد باعث HDN در نوزادان میشود.
کومبز غیرمستقیم
از کومبز غیرمستقیم برای شناسای RBC حساس شده در محیط In vitro استفاده میشود. مرحله حساس شدن RBCها در این روش توسط انکوباسیون انجام میشود. مراحل بعدی تقریبا مشابه کومبز مستقیم است. در این تست آنتیبادیهای ناقص، در خون مریض (مادر) وجود دارد. این آنتیبادیها به دو علت عمده ممکن است تولید شوند:
۱. انتقال خون
۲. زایمان اول
برای بررسی وجود و یا عدم وجود این آنتیبادی، از سوسپانسیون ۵ درصد RBC، گروه خونی +O استفاده میشود. چون آنتیبادیهای ناقص، شاخصهای آنتیژن RBCهای گروه خونی +O را حساس و با اضافه کردن AHG باعث ایجاد آگلوتیناسیون میشود.
علت استفاده از +O
برای اینکه ناسازگاری گروههای خونی ABO را از بین ببریم از این گروه خونی استفاده میکنیم چون اگر گروههای خونی A,B,AB استفاد شود، در این صورت ممکن است آنتیبادی ضد AB گروه خونی O باعث حساس شدن سوسپانسیون شود.
و علت اینکه از +RH استفاده میکنیم این است که میخواهیم آنتیبادیهای ناقص بر روی آنتیژنهای +RH بشیند و بتوانیم آگلوتیناسیون را مشاهده کنیم. اگر -RH باشد در روی RBC، آنتیژنی وجود نخواهد داشت تا RBC توسط آنتیبادی حساس شود.
روش انجام تست کومبز غیرمستقیم
۰/۱ میلیمتر از سرم بیمار را با ۱/۰ میلیمتر از سوسپانسیون ۵ درصد مخلوط میکنیم و سپس لوله آزمایش را به مدت ۳۰ تا ۴۰ دقیقه در انکوباتور ۳۷ درجه قرار میدهیم در این مرحله RBC در صورت وجود آنتیبادی ناقص در سرم، حساس خواهند شد. بعد از این مدت، لوله آزمایش را به مدت یک دقیقه در دور ۱۰۰۰ سانتریفیوژ میکنیم. و سه بار توسط سرم فیزیولوژی شستشو میدهیم تا آنتیبادیهای غیراختصاصی حذف شوند و فقط آنتیبادیهای اختصاصی که به شاخصهای آنتیژنی RBC چسبیدهاند، باقی بمانند. بعد از این مراحل یک قطره AHG به لوله اضافه میکنیم و بعد از ۳ تا ۵ دقیقه لوله را به مدت یک دقیقه در دور ۱۰۰۰ سانتریفیوژ میکنیم و در آخر هم با زدن ضربهای ضعیف آگلوتیناسیون را بررسی میکینم.
بررسی نتایج
اگر آگلوتیناسیون مشاهده شود تست کومبز غیرمستقیم بیمار را مثبت گزارش میکنیم.
چند نکته:
۱ـ قبل از انکوبه با اضافه کردن دو قطره آلبومین میتوان آگلوتیناسیون را بهتر بررسی کرد.
۲ـ اگر بعد از انکوبه، آگلوتیناسیون مشاهد شود نشان دهنده این نکته است که در سرم ما آنتیبادی کامل وجود دارد و در واقع Back Type را انجام دادهایم.
۳- برای بررسی آگلوتیناسیون بهتر است از میکروسکوپ استفاده کنیم.
روش تهیه سوسپاسیون ۵ درصد
۲ قطره خون داخل لوله آزمایش میریزیم. ۳ میلیلیتر سرم فیزیولوژی به لوله اضافه میكنیم و در سانتریفیوژ در دور ۳۰۰۰ به مدت ۵ دقیقه قرار میدهیم سپس مایع رویی را خالی كرده و این كار را تا ۳ بار تكرار میكنیم.
ادامه مطلب...
برای مشاهده کلیه مطالب به تفکیک موضوعات آزمایشگاهی، بر روی ادامه مطلب کلیک کنید، همچنین میتوانید از منو دسته بندی مورد نظر را انتخاب نمایید
ادامه مطلب...