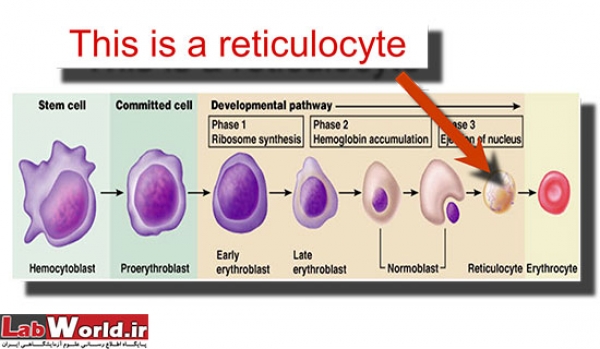
رتيکولوسيت ها گلبولهای قرمز نابالغ حاوی باقيمانده های اسيد ريبونوکلئيک ريبوزومی هستند که به تازگی از مغز استخوان آزاد شده اند . ويژگی ريبوزوم ها ، ايجاد واکنش با رنگهای قليائی خاص مثل آزور B ، بريليانت کرزيل بلو يا نيو متيلن بلو (NMB) و تشکيل رسوبی بصورت گرانول يا فيلامانت آبی يا بنفش می باشد . اين واکنش فقط با رنگهای حياتی و در نمونه های فيکس نشده صورت می گيرد. به علت زنده بودن سلول ها هنگام رنگ آميزی، به اين نوع رنگ آميزی، رنگ آميزی حياتی اطلاق می گردد.
مراحل مختلف بلوغ رتيکولوسيت ها با توجه به مشخصات مرفولوژيکی، قابل شناسايی می باشند. نابالغ ترين رتيکولوسيت ها حاوی بيشترين مقدار مواد رسوبی ، و بالغ ترين آنها فقط دارای چند جز يا رشته کوتاه از اين مواد مي باشند. بر اين اساس ، رتيکولوسيت ها به چهار گروه تقسيم می شوندکه گروه1 دارای کلامپ رتيکولوم و گروه 4 حاوی چند گرانول کوچک می باشند. گروه 2 و3 نيز از لحاظ مرفولوژی بين اين دو گروه قرار می گيرند. چون اکثر رتيکولوسيت هايی که در خون محيطی ديده می شوند از گروه4 هستند، شناسايي دقيق رتيکولوسيتها اثر قابل توجهی بر روی صحت شمارش اين سلولها دارد . بنابراين گلبولی می بايست به عنوان رتيکولوسيت شمارش گردد که دارای هسته نبوده و داخل آن دو يا چند قطعه از رسوب آبی رنگ ، که همان RNA ريبوزومی است، ديده شود.
رتيکولوسيتها در رنگ آميزی معمولی ( با رنگ های گروه رومانوفسکی)، بدليل ترکيب بازوفيلي سيتوپلاسم و اسيدوفيل هموگلوبين حالت بازوفيل منتشری پيدا کرده و به بصورت "پلی کروماتيک" مشاهده می گردند . اين پديده بطور معمول در رتيکولوسيتهای نابالغ که دارای بيشترين ميزان RNA هستند،ديده مي شود .
رنگ آميزی
1-تهيه محلول رنگ
رنگ توصيه شده در مراجع معتبر بين المللی نيو متيلن بلو می باشد که به صورت تجاری به نام رنگ رتیکولوسیت قابل تهیه است. برای تهيه محلول رنگ، می بايست 1/0 گرم رنگ نيومتيلن بلو (NMB يا آزور B خالص را در 100 ميلی ليتر بافر فسفات ايزو اسموتيک با 6.5=PH حل نمود). برای ساخت بافر ذکر شده از محلولهای زير استفاده می شود:
A: NaH2PO4 , 2H2O 23.4g/L (150mmol/L)
B: Na2HPO4 21.3 g/L (150mmol/L)
در صورتيکه 51 ميلی ليتر از محلول A با 35 ميلی ليتر از محلول B مخلوط گردد ، PH بافر حاصل ، 6.5 خواهد بود .
رنگ را ميتوان در100 ميلی ليتر سيترات سالين نيز حل کرد که برای تهيه سيترات سالين ، يک حجم سيترات سديم 30 گرم در ليتر با 4 حجم کلريد سديم 9 گرم در ليتر مخلوط می شود.
محلول رنگ را می بايست درون شيشه ای قهوه ای رنگ ريخته و در مدت 24 ساعت به دفعات تکان داد. اين محلول در دمای 6-2 درجه سانتيگراد قابل نگهداری می باشد. در اين دما، نيمه عمر رنگ حدود يک ماه است. هر بار قبل از استفاده، بايد حجم مورد نياز از رنگ را به منظور خارج نمودن هر گونه ذره اضافی يا رسوب، با کاغذ صافی فيلتر نمود.
2-روش رنگ آميزی
برای رنگ آميزی بايد دو يا سه قطره رنگ NMB را با پيپت پاستور داخل لوله شيشه ای يا پلاستيکی به ابعاد 10×75 ميلی متر ريخته و به همين حجم، خون حاوی ضد انعقاد EDTA به آن اضافه کرده و پس از مخلوط کردن به مدت 15 تا 20 دقيقه در دمای 37 درجه نگهداری نمود . قبل از تهيه گسترش می بايست لوله را به آرامی تکان داد تا گلبولهای قرمز مجددا به حالت سوسپانسيون درآيند. گسترش ها پس از تهيه و خشک شدن، بدون فيکساسيون و انجام رنگ آميزی ديگری،توسط ميکروسکوپ قابل بررسی می باشند .
حجم دقيق خونی که به محلول رنگ اضافه می شود بستگی به تعداد گلبولهای قرمز دارد . در موارد آنمی، مقدار خون بيشتر و در پلی سيتمی، مقدار خون کمتری ، نسبت به حالت طبيعی ، می بايست با رنگ مخلوط شود .
در يک گسترش مناسب ، ريبوزوم رتيکولوسيت ها به رنگ آبی در آمده و سلولهای بالغ در سطح لام به شکل سايه های کمرنگ آبی مايل به سبز ديده می شوند .
رنگ آميزی و شمارش رتيکولوسيت خون در شرايطی که نمونه بعد از نمونه گيری در دمای 6-2 درجه نگهداری شود تا 24 ساعت امکانپذير می باشد . با گذشت 8-6 ساعت از زمان نمونه گيری و ماندن خون در حرارت آزمايشگاه ، رتيکولوسيت ها به تدريج بالغ شده و به گلبول قرمز بالغ تغيير مي يابند که اين امر بطور کاذب موجب کاهش درصد رتيکولوسيت ها می گردد. بنابراين توصيه می شود شمارش رتيکولوسيت بلافاصله بعد از جمع آوری نمونه انجام شود.
نحوه شمارش و گزارش درصد رتيکولوسيت
برای شمارش و تعيين درصد رتيکولوسيت ، گسترش نبايد خيلی نازک تهيه شده باشد و محلی از گسترش جهت شمارش انتخاب شود که سلولها به خوبی رنگ شده و روی هم نيز قرار نگرفته باشند . برای تعيين درصد رتيکولوسيت ها از عدسی شيئ روغنی و در صورت امکان از عدسی های چشمی دارای ديافراگم قابل تنظيم استفاده ميشود. تعداد گلبولهای قرمزی که بايد مورد ارزيابی قرارگيرند رابطه معکوس با تعداد رتيکولوسيت ها دارد. بنابراين به منظور افزايش دقت در شمارش ، هرچه تعداد رتيکولوسيت ها کمتر باشد می بايست تعداد گلبولهای قرمز بيشتری مورد بررسی قرارگيرند و بالعکس.
مقادير مرجع
در بزرگسالان سالم شمارش رتيکولوسيت 1.5-0.5 درصد و در نوزادان 6-2 درصد می باشد که تا انتهای هفته دوم زندگی، به ميزان بزرگسالان تنزل می يابد.
افتراق رتيکولوسيت ها از ديگر انکلوزيونهای گلبولهای قرمز
انکلوزيونهای ديگری مثل هاينز بادی Hb H، هاول ژولی بادی و اجسام پاپن هايمر در تشخيص افتراقی با رتيکولوم رتيکولوسيت ها قرار می گيرند که در جدول زير مشخصات هريک آمده است.
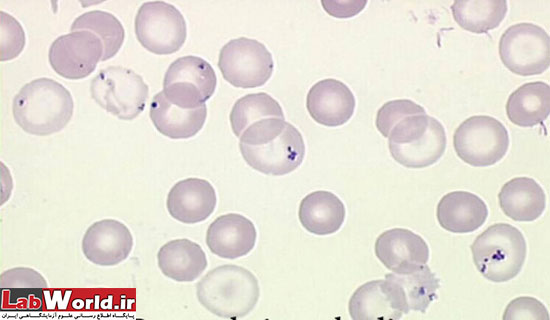
در بين اين انکلوزيونها، مشکل عمده اجسام هاينز هستند که هر چند در رنگ آميزی NMB به رنگ آبی روشن تری مشاهده شده و عمدتا در حاشيه و نزديک به غشا سلول قرار ميگيرند ولی تفکيک آنها از دانه های ريبوزومی بسيار مشکل است. برای برطرف کردن اين مشکل می توان اسمير رنگ شده رتيکولوسيت را با متانول فيکس کرد که اين امر موجب بی رنگ شدن اجسام هاينز شده ولی تاثيری بر روی رتيکولوسيت ندارد.
جدول مشخصات ظاهری انکلوزيون های مختلف گلبول قرمز در رنگ آميزی روش NMB
| نام | ماهیت | مشخصات |
|
رتيکولوم رتيکولوسيت |
RNA ريبوزومی | رشته های رتيکولوم يا گرانول های کوچک پراکنده |
 |
||
| نام | ماهیت | مشخصات |
|
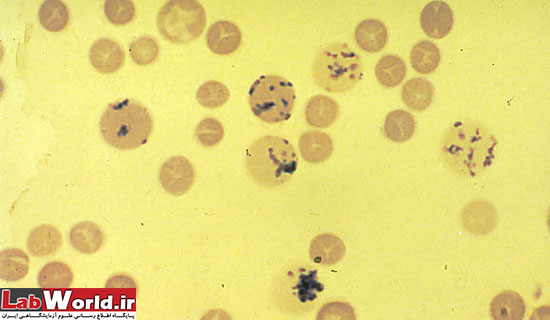
پاپن هايمر |
انکلوزيون حاوی آهن | يک يا بيشتر گرانول آبی رنگ با تمايل به حاشيه سلول که از رتيکولوم ، تيره تر رنگ می گيرند |
 |
||
| نام | ماهیت | مشخصات |
|
هاينز بادی |
هموگلوبين دناتوره | بزرگتر از پاپن هايمر با شکل نامنظم ، آبی کمرنگ ، معمولا چسبيده به غشا سلول ، که گاهی باعث برآمدگی غشا به بيرون می گردد |
 |
||
| نام | ماهیت | مشخصات |
|
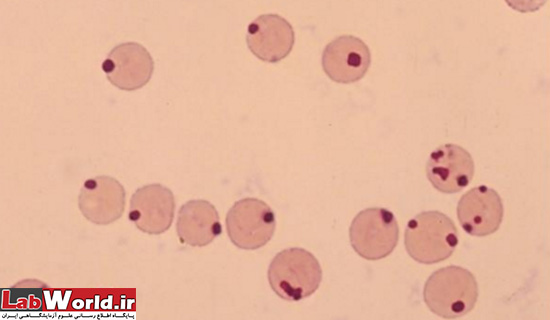
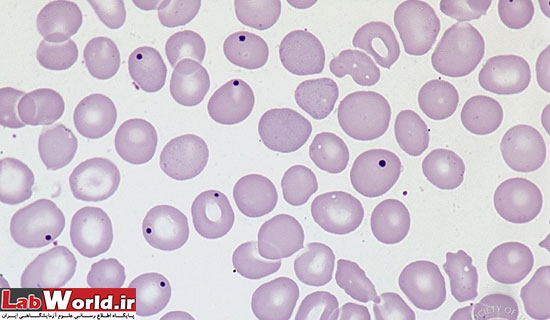
هاول ژولی بادی |
DNA | بزرگتر از پاپن هايمربا شکل منظم، آبی کمرنگ که با فاصله از غشا سلول قرار می گيرند |
 |
||
| نام | ماهیت | مشخصات |
|
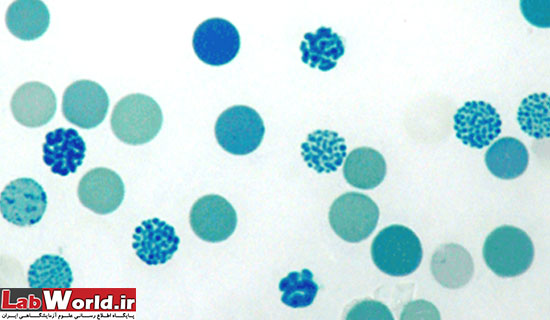
Hb H |
تترامر زنجيره ß هموگلوبين | بصورت متعدد (multiple) و گرد ،به رنگ آبی-سبزکه به سلول ظاهر توپ گلف می- دهد، معمولا با انکوباسيون کوتاه مدت مشخص نمی گردد و برای شکل گيری نيازمند زمان است |
 |
||
References:
1-H44-A methods for Reticulocyte counting(Flow Cytometry and Supravital Dye); Approved Guideline, NCCLS VOL.17 NO.18
2-Dacie and Lewis PRACTICAL HAEMATOLOGY, TENTH EDITION